|
Protirakovinové účinky organicky viazaného jódu
Viacero experimentálnych vedeckých štúdií na zvieratách a klinických štúdií u ľudí z obdobia 1993 – 2006 poukázalo na liečebný potenciál molekulárneho jódu (I2) využiteľného v liečbe rakoviny (Ghent et al. 1993, Eskin et al. 1995, Funahashi et al. 1996, Kessler 2004, Garcia-Solis et al. 2005).
V uvedenom období bol objavený mechanizmus pôsobenia jódu a skupina látok nazvaná jódolaktóny.
Čo sú to jódolaktóny?
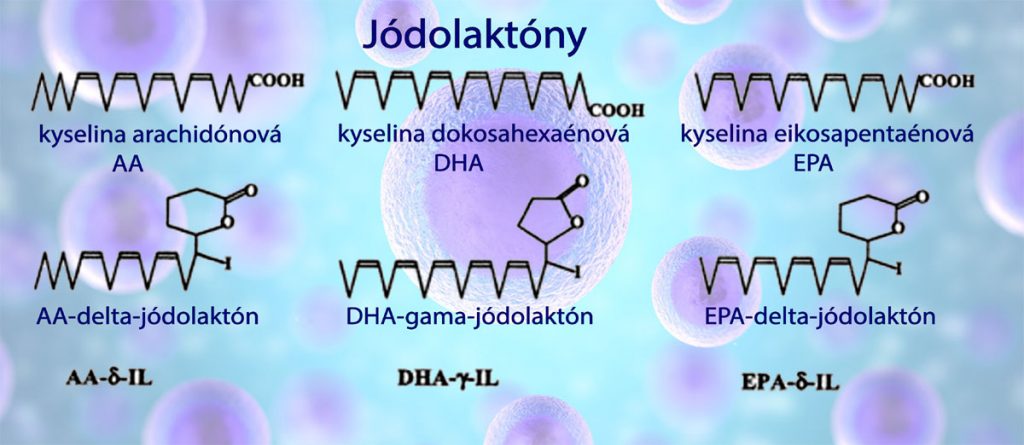
Jódolaktóny patria medzi jódolipidy. Sú to organické zlúčeniny jódu vznikajúce v tele konverziou nenasýtených mastných kyselín a zabudovaním molekúl jódu. Jód sa dokáže v bunkových stenách organicky viazať na nenasýtené mastné kyseliny obsahujúce dvojité väzby, napríklad na kyselinu arachidónovú (AA), kyselinu eikosapentaénovú (omega-3 EPA) a kyselinu dokosahexaénovú (omega-3 DHA) za vzniku takzvaných jódolipidov alebo jódolaktónov.
Jódolaktóny sú signálne molekuly. Majú schopnosť navodiť apoptózu – geneticky programovaný zánik buniek. Apoptóza je veľmi dôležitý mechanizmus kontroly delenia buniek, zúčastňuje sa reparačných mechanizmov, odstráňovania poškodených buniek a tkanív. Rakovinové bunky strácajú schopnosť apoptózy, čo umožňuje neobmedzené, nekontrolované delenie.
Jódolaktóny sa zúčastňujú autoregulácie funkcie štítnej žlazy. Opuch, zväčšenie a nadmerná tvorba tyroxínu vzniká pri poruche biologickej kontroly vyplýva z deficitu jódolaktónov. Jódolaktóny obnovujú mechanizmus apoptózy a kontrolujú procesy, aby nedochádzalo k hyperfunkcii alebo hypertrofii tkaniva (zväčšovaniu).
Jódoaktóny na rozdiel od chemoterapie nepôsobia toxicky a nespôsobujú nekrózu zdravých buniek. Pôsobia výlučne fyziologickým mechanizmom indukcie apoptózy. Účinok jódolaktónov je teda vysoko selektívny, nepoškodzuje zdravé tkanivá.
Jódolaktóny majú antiproliferatívny účinok – zabraňujú deleniu rakovinových buniek už vo veľmi nízkych koncentráciách.
Uvedený mechanizmus pôsobenia jódolaktónov je predmetom intenzívneho výskumu pre enormný potenciál pri cielenej liečbe rakoviny.
Doposiaľ boli identifikované viaceré jódolipidy, predmetom záujmu sa však stali najmä delta-jódolaktón (6-IL) a EPA-jódolaktón s preukázaným protirakovinovým pôsobením.
Ako vznikajú jódolaktóny?
Tvorba jódolaktonov prebieha zložitými biochemickými mechanizmami aktívneho prenosu jódu a pôsobením enzýmu peroxidáza na anorganické jodidy. Proces prebieha v bunkových stenách. Najťažšou úlohou enzýmov je rozštiepiť anorganické soli jódu za účelom získania molekúl jódu pre syntézu jódolipidov a jódolaktónov. Uvedené skutočnosti potvrdzujú výsledky štúdií, ktoré poukazujú na chýbajúce antiproliferatívne účinky anorganických foriem jódu.
Po podávaní elementárneho jódu u zvierat aj u ľudí dochádzalo k významnému nárastu tvorby jódolaktónu pozorovateľné obzvlášť v bunkových stenách rakovinových buniek ktoré sú charakteristické až 6-násobne vyššou koncentráciou kyseliny arachidónovej v porovnaní s normálnymi bunkami. Molekulárny jód sa prednostne viaže na kyselinu arachidónovú a vytvára jódolaktóny.
Z experimentálnych štúdií vyplýva, že jódolaktóny vznikajú vo vyššej koncentrácii v prítomnosti molekulárneho jódu (elementárneho jódu – ako I2). Najvyužiteľnejším substrátom – zdrojom pre tvorbu jódolaktónov sú jódolipidy – jódované mastné kyseliny. Jódované mastné kyseliny obsahujú molekuly jódu viazaného organickou väzbou na tuky, ich premena na jódolaktóny je priama aoveľa jednoduchšia a účinnejšia. Príkladom praktického využitia jódolipidov v prevencii a terapii je Rybí olej s organicky viazaným jódom.
Jódolaktóny sa môžu vytvárať v princípe v ktoromkoľvek orgáne pod podmienkou prítomnosti peroxidázy. Ak sa však pristúpi k podávaniu elementárneho jódu alebo organicky viazaného jódu, účinnosť tvorby je niekoľkonásobne vyššia. Prítomnosť peroxidázy nie je potrebná a vznik jódolipidov je v tomto prípade zjednodušený, výsledkom je vyššia koncentrácia jódolaktónov.
Aké typy jódolaktónov vznikajú v bunkových stenách?
V súčasnosti sú známe jódolaktóny odvodené od polynenasýtených mastných kyselín. AA-delta jódolaktón vytvárajúci sa z kyseliny arachdónovej, EPA-delta jódolaktón vytvárajúci sa z kyseliny eikosapentaénovej a DHA- gama jódolaktón vznikajúci z kyseliny eikosapentaénovej a organického jódu. Proapoptoické, protirakovinové a antiproliferatívne účinky boli dokázané pri AA- a EPA-jódolaktóne. Uvedené typy jódolaktónov dokážu navodiť apoptózu buniek už pri veľmi nízkej koncentrácii 5 mcmol/l. Na obrázku nižšie sú polynenasýtené mastné kyseliny a z nich vzniknuté jódolaktóny. Experimentálne výsledky: rakovinové bunky sú citlivejšie na molekulárny jód
Podľa výsledkov mexickej štúdie z roku 2008 rakovinové bunky sú oveľa citlivejšie na podávanie molekulárneho jódu (I2) ako normálne bunky. Uvedená hypotéza vychádza z exaktných hodnôt minimálnych koncentrácií, pri ktorých dochádzalo k apoptóze – zániku buniek.
Už relatívne nízke a stredné koncentrácie elementárneho jódu (10 – 20 µM) alebo delta-jódolaktónu (0,5 µM) dokážu navodiť apoptózu rakovinových buniek, zatiaľ čo u normálnych buniek dochádza k navodeniu apoptózy až pri vyššej koncentrácii elementárneho jódu (40 µM).
Výsledky potvrdzujú že rovnako elementárny jód ako aj delta-jódolaktón aktivujú rovnaký intracelulárny (vnútrobunkový) mechanizmus.
Antineoplastické – protirakovinové účinky zahŕňajú väzbu elementárneho jódu na kyselinu arachidónovú, eikosapentaénovú a vznik delta-jódolaktónov.
Zdroje:
1. O.Arroyo-Helguera, E Rojas,G.Delgado,C.Aceves: Signaling pathways involved in the antiproliferative effect of molecular iodine in normal and tumoral breast cells: evidence that 6-iodolactone mediates apoptotic effects; Endoc.Cancer 2008;15:1003
2. C.Aceves et al:Antineoplastic effect of iodine in mammary cancer: participation of 6-iodolactone (6-IL) and peroxisome proliferator-activated receptors (PPAR); Mol.Cancer 2009; 8:33
Cytotoxická aktivita molekulárneho jódu a jódolaktónov testovaná na 12 rozličných typoch izolovaných ľudských rakovinových buniek. Dôkaz o indukcii apoptózy bez ovplyvnenie EGF-signálnej cesty.
Cytotoxický a antiproliferatívny potenciál (zastavujúci delenie buniek) molekulárneho jódu a jódolaktónov bol skúmaný na 12 rôznych typoch izolovaných ľudských rakovinových buniek a jednom type normálnych buniek. S výnimkou rakovinových buniek hrubého čreva (CCL221) sa rast všetkých ďalších 11 typov rakovinových buniek spomalil, ak tieto bunky boli vystavené pôsobeniu molekulárneho jódu v koncentrácii 10 microM počas najmenej 2 dní. Delta-jódolaktón mal v koncentrácii 5 mikroM podobné účinky.
Najcitlivejšie na účinky molekulárneho jódu a delta-jódolaktónu sa ukázali bunky neuroblastómu (SH-SY5Y), ďalej bunky karcinómu prsníka (MCF-7) s mierou inhibície 60% a 77,7% a bunky karcinómu pľúc 36,3% a 40,3%. V protiklade s účinkami na rakovinových bunkách, normálne epitelové bunky prsníka boli podstatne menej citlivé na účinky jódu. Pri typoch buniek SH-SY5Y a MCF-7 molekulový jód a jódolaktón úplne zrušil EGF faktorom zapríčinené delenie buniek. Prerušenie delenia buniek však nebolo spôsobené zasiahnutím EGF signálnej cesty pretože I2 a IL neovplyvnili fosforyláciu EGF-receptora ani EGF-indukovanú aktiváciu MAP-kinázy. Prerušenie delenia molekulárnym jódom bolo možne eliminovať prítomnosťou N-acetylcysteínu, z čoho vyplýva že jód (I2) aktivuje mitochondriálny mechanizmus apoptózy buniek.
Zdroj: Rösner H, Torremante P, Möller W, Gärtner R.: Antiproliferative/cytotoxic activity of molecular iodine and iodolactones in various human carcinoma cell lines. No interfering with EGF-signaling, but evidence for apoptosis; Exp Clin Endocrinol Diabetes. 2010 Jul;118(7):410-9.
Prečítajte si tiež: |
- Nutraceutiká vo výžive
- Omega3
- Cievne choroby
- Mastné kyseliny
- Účinky
- Imunitný systém
- Alergia
- Astma
- Suchá pokožka
- Nervové choroby
- Očné choroby
- Ženské choroby
- Rizikové tehotenstvo
- Dávkovanie omega-3 počas tehotenstva
- Dojčiace matky
- Starnutie
- Rakovina tlmenie rastu nádorov
- Rakovina omega-3 zvyšuje účinnosť chemoterapie
- Metabolizmus
- Obsah v potravinách
- Ideálne zastúpenie
- Ľanový alebo prírodný rybí olej?
- Optimálny príjem
- Záver
- Čierne korenie
- Enzýmy
- Gurmar
- Horká tekvička
- Chlorella
- Jód
- Karnozín
- Koenzým Q10
- Kokosový olej
- Konopný olej
- Kurkuma
- Kyselina alfa-lipoová
- Mladý jačmeň
- Nikotínamid mononukleotid
- Stévia
- Škorica
- Tekvicový olej
- Vitamín A
- Vitamín D
- Vitamín E
- Zázvor
- Zelený čaj
- Železo
- Omega3
- Nutraceutiká a ochorenia
- Alergia
- Bolesť chrbtice
- Cukrovka
- GcMAF imunoterapia
- Epilepsia
- Hypertrofia prostaty
- Chrípka
- Mozog a nootropiká
- Nízkosacharidová diéta
- Očkovanie prevencia reakcií
- Očné choroby
- Oslabená imunita
- Opar na perách
- Oslabený rast vlasov
- Raynaudov syndróm
- Reumatoidná artritída
- Srdcovo cievne choroby
- Vysoký krvný tlak
- Žilová trombóza
- Produkty
- Všetky produkty
- Omega-3 rybí olej natural
- Rybí olej s vitamínom D
- Rybí olej s organicky viazaným jódom
- Rybí olej s koenzýmom Q10
- Horká tekvička čaj
- VerbePLX kapsuly
- Gurmar antidiabetický čaj
- Karnozín
- Nikotínamid mononukleotid
- Turmerix – kurkumové kapsle
- OraMAF suspenzia
- Prírodný vitamín E
- Serapeptáza
- Blog
- Rybí olej – užívanie
- Kontakt
- Nutraceutiká vo výžive
- Omega3
- Cievne choroby
- Mastné kyseliny
- Účinky
- Imunitný systém
- Alergia
- Astma
- Suchá pokožka
- Nervové choroby
- Očné choroby
- Ženské choroby
- Rizikové tehotenstvo
- Dávkovanie omega-3 počas tehotenstva
- Dojčiace matky
- Starnutie
- Rakovina tlmenie rastu nádorov
- Rakovina omega-3 zvyšuje účinnosť chemoterapie
- Metabolizmus
- Obsah v potravinách
- Ideálne zastúpenie
- Ľanový alebo prírodný rybí olej?
- Optimálny príjem
- Záver
- Čierne korenie
- Enzýmy
- Gurmar
- Horká tekvička
- Chlorella
- Jód
- Karnozín
- Koenzým Q10
- Kokosový olej
- Konopný olej
- Kurkuma
- Kyselina alfa-lipoová
- Mladý jačmeň
- Nikotínamid mononukleotid
- Stévia
- Škorica
- Tekvicový olej
- Vitamín A
- Vitamín D
- Vitamín E
- Zázvor
- Zelený čaj
- Železo
- Omega3
- Nutraceutiká a ochorenia
- Alergia
- Bolesť chrbtice
- Cukrovka
- GcMAF imunoterapia
- Epilepsia
- Hypertrofia prostaty
- Chrípka
- Mozog a nootropiká
- Nízkosacharidová diéta
- Očkovanie prevencia reakcií
- Očné choroby
- Oslabená imunita
- Opar na perách
- Oslabený rast vlasov
- Raynaudov syndróm
- Reumatoidná artritída
- Srdcovo cievne choroby
- Vysoký krvný tlak
- Žilová trombóza
- Produkty
- Všetky produkty
- Omega-3 rybí olej natural
- Rybí olej s vitamínom D
- Rybí olej s organicky viazaným jódom
- Rybí olej s koenzýmom Q10
- Horká tekvička čaj
- VerbePLX kapsuly
- Gurmar antidiabetický čaj
- Karnozín
- Nikotínamid mononukleotid
- Turmerix – kurkumové kapsle
- OraMAF suspenzia
- Prírodný vitamín E
- Serapeptáza
- Blog
- Rybí olej – užívanie
- Kontakt
Protirakovinové účinky jódu
You are here:
- Home
- Nutraceutiká vo výžive
- Jód
- Protirakovinové účinky jódu